Внимание!!! Следующее занятие очно-заочной школы по химии для 9 класса состоится 19 декабря в 12.50
5 декабря состоялось занятие № 7 для 9 класса по теме: «Химия металлов. Решение заданий олимпиад.»
Домашнее задание для 9 класса:
Сборка олимпиадных задач №7.
1. Назовите химические элементы, в названиях которых отразился цвет простого вещества или соединения?
2. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
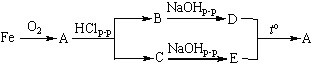
Назовите вещества, обозначенные буквами А, В, С, D и E.
3. В заливе Кара-Богаз-Гол Каспийского моря находятся богатейшие запасы минерала мирабилита — кристаллогидрата сульфата натрия. Каждый год в конце ноября, когда температура воды падает до 6°С, вода оказывается насыщенной сульфатом натрия, и мирабилит начинает выделяться в виде бесцветных кристаллов, оседающих на дно залива и на его берегах. Эти кристаллы содержат в своем составе соль и воду.
Для определения формулы мирабилита растворили 3,22 г минерала в воде. К полученному раствору прилили избыток раствора хлорида бария. Выпавший осадок был отфильтрован, промыт и взвешен. Его масса оказалась равной 2,33 г. На основе химического анализа определите формулу минерала мирабилита. Запишите уравнение реакции.
4. История открытия этого элемента такова. В 1801 г. мексиканский химик-минералог Андреас-Мануэль дель Рио получил оксиды и соли неизвестного химического элемента, названного им эритронием. Однако ученый усомнился в правильности своих анализов, и сделал вывод, что эритроний не новый химический элемент, а оксид хрома.
В 1830 г. профессор Стокгольмского Горного института Нильс Габриель Сефстрем открыл в шлаке, полученном при выплавке чугуна, новый металл. Он отличался высокой химической стойкостью и растворялся лишь в царской водке и концентрированной плавиковой кислоте, а при нагревании в азотной и концентрированной серной кислоте. При нагревании на воздухе металл окислялся до оксида. При этом 1,00 г металла давал 1,785 г порошка красно-коричневого цвета. В 1831 г немецкий химик Фридрих Вёлер доказал, что открытый металл и эритроний — одно и то же вещество.
Какой элемент был открыт химиками? Ответ подтвердите расчетами. Запишите уравнение реакции окисления металла кислородом воздуха.
5. Многие химические процессы протекают с выделением теплоты. Эту особенность химических реакций можно использовать в быту. Ученые сконструировали так называемые химические грелки, в которых выделяющееся тепло используют для согревающего компресса. Простейшая грелка состоит из пластикового пакета с пересыщенным раствором тиосульфата натрия (Na2S2O3). Пересыщенные растворы очень неустойчивы. При попадании кристаллов вещества или перемешивании они начинают кристаллизоваться. При этом из пересыщенного раствора выделяется кристаллогидрат тиосульфата натрия (Na2S2O3·5Н2О) и выделяется теплота.
Предложите свои два варианта химической грелки. Запишите уравнения реакции, лежащей в основе ее работы.
6. Предлагаем приготовить «шипучку» — порошок, который при добавлении воды начинает «закипать», образуя газированный напиток, и хорошо удаляет жажду. Его приготовление основано на реакции лимонной кислоты с питьевой содой (NaHCO3). Чтобы сделать «шипучку», в пищевой посуде смешайте четверть чайной ложки питьевой соды, половину чайной ложки лимонной кислоты и чайную ложку сахара. Если приготовленную смесь высыпать в стакан с водой и перемешать, то выделится газ, а смесь приобретет кисловатый вкус.
|
продукт |
стакан |
ложка |
||
|
250 см3 |
200 см3 |
столовая, г |
чайная, г |
|
|
Вода |
250 |
200 |
18 |
5 |
|
Сахар-песок |
220 |
180 |
25 |
10 |
|
Сода питьевая |
– |
– |
25 |
10 |
|
Лимонная кислота |
– |
– |
15 |
5 |
Если соды взять слишком много, то вкус будет слегка горьковатый, если слишком мало — очень кислый. Вы можете сами подобрать такое соотношение соды и лимонной кислоты, чтобы вкус напитка был наиболее приятным.
- Составьте уравнение описанной реакции, приняв для лимонной кислоты условную формулу Н3Э (или зная, что лимонная кислота трехосновная).
- Используя данные таблицы, рассчитайте концентрацию каждого компонента смеси в стакане с водой до начала реакции;
- В каком мольном соотношении должны быть реагирующие компоненты, чтобы вкус напитка был кисловатым?
- Почему при избытке соды раствор становится горьковатым на вкус?
7. В водно-спиртовом растворе хлорида цинка было обнаружено 1,806·1022 хлорид-ионов и 11,56 г соли, не распавшейся на ионы. Определите степень диссоциации соли (в %) в этом растворе.
8. Неизвестный алкен массой 7 г присоединяет бромоводород, объём которого одинаков с объёмом метана массой 2 г (н.у.) Найдите молекулярную формулу алкена и напишите структурные формулы его изомеров.
9. При пропускании 15,68 л смеси метана, углекислого газа и угарного газа через раствор гидроксида калия, взятого в избытке, объем исходной смеси уменьшился на 8,96 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л (н.у.) кислорода.
Определите объемные доли компонентов в исходной смеси.
10. Соль А является соединением металла Х, окрашивающим бесцветное пламя газовой горелки в жёлтый цвет. При нагревании до 300°С А разлагается с образованием хорошо растворимой в воде соли Б. Взаимодействие раствора гидроксида кальция с раствором соли Б или с раствором соли А приводит к выпадению осадка вещества В, которое разлагается при нагревании до 1000°С на газ Г (без запаха) и твёрдое вещество Д. Пропускание газа Г через раствор соли Б приводит к образованию А.
Определите вещества А–Д, напишите уравнения реакций.



