Внимание!!! Следующее занятие очно-заочной школы по химии для 9 класса состоится 11 января в 11.20
21 декабря состоялось занятие № 7 для 9 класса по теме: «ОВР. Электролиз. Гальванический элемент. Решение заданий олимпиад.»
Домашнее задание для 9 класса:
Сборка олимпиадных задач №7.
1. Назовите химические элементы, в названиях которых отразился цвет простого вещества или соединения?
2. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
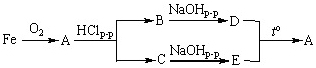
Назовите вещества, обозначенные буквами А, В, С, D и E.
3. В заливе Кара-Богаз-Гол Каспийского моря находятся богатейшие запасы минерала мирабилита — кристаллогидрата сульфата натрия. Каждый год в конце ноября, когда температура воды падает до 6°С, вода оказывается насыщенной сульфатом натрия, и мирабилит начинает выделяться в виде бесцветных кристаллов, оседающих на дно залива и на его берегах. Эти кристаллы содержат в своем составе соль и воду.
Для определения формулы мирабилита растворили 3,22 г минерала в воде. К полученному раствору прилили избыток раствора хлорида бария. Выпавший осадок был отфильтрован, промыт и взвешен. Его масса оказалась равной 2,33 г. На основе химического анализа определите формулу минерала мирабилита. Запишите уравнение реакции.
4. История открытия этого элемента такова. В 1801 г. мексиканский химик-минералог Андреас-Мануэль дель Рио получил оксиды и соли неизвестного химического элемента, названного им эритронием. Однако ученый усомнился в правильности своих анализов, и сделал вывод, что эритроний не новый химический элемент, а оксид хрома.
В 1830 г. профессор Стокгольмского Горного института Нильс Габриель Сефстрем открыл в шлаке, полученном при выплавке чугуна, новый металл. Он отличался высокой химической стойкостью и растворялся лишь в царской водке и концентрированной плавиковой кислоте, а при нагревании в азотной и концентрированной серной кислоте. При нагревании на воздухе металл окислялся до оксида. При этом 1,00 г металла давал 1,785 г порошка красно-коричневого цвета. В 1831 г немецкий химик Фридрих Вёлер доказал, что открытый металл и эритроний — одно и то же вещество.
Какой элемент был открыт химиками? Ответ подтвердите расчетами. Запишите уравнение реакции окисления металла кислородом воздуха.
5. Многие химические процессы протекают с выделением теплоты. Эту особенность химических реакций можно использовать в быту. Ученые сконструировали так называемые химические грелки, в которых выделяющееся тепло используют для согревающего компресса. Простейшая грелка состоит из пластикового пакета с пересыщенным раствором тиосульфата натрия (Na2S2O3). Пересыщенные растворы очень неустойчивы. При попадании кристаллов вещества или перемешивании они начинают кристаллизоваться. При этом из пересыщенного раствора выделяется кристаллогидрат тиосульфата натрия (Na2S2O3·5Н2О) и выделяется теплота.
Предложите свои два варианта химической грелки. Запишите уравнения реакции, лежащей в основе ее работы.
6. Предлагаем приготовить «шипучку» — порошок, который при добавлении воды начинает «закипать», образуя газированный напиток, и хорошо удаляет жажду. Его приготовление основано на реакции лимонной кислоты с питьевой содой (NaHCO3). Чтобы сделать «шипучку», в пищевой посуде смешайте четверть чайной ложки питьевой соды, половину чайной ложки лимонной кислоты и чайную ложку сахара. Если приготовленную смесь высыпать в стакан с водой и перемешать, то выделится газ, а смесь приобретет кисловатый вкус.
|
продукт |
стакан |
ложка |
||
|
250 см3 |
200 см3 |
столовая, г |
чайная, г |
|
|
Вода |
250 |
200 |
18 |
5 |
|
Сахар-песок |
220 |
180 |
25 |
10 |
|
Сода питьевая |
– |
– |
25 |
10 |
|
Лимонная кислота |
– |
– |
15 |
5 |
Если соды взять слишком много, то вкус будет слегка горьковатый, если слишком мало — очень кислый. Вы можете сами подобрать такое соотношение соды и лимонной кислоты, чтобы вкус напитка был наиболее приятным.
a. Составьте уравнение описанной реакции, приняв для лимонной кислоты условную формулу Н3Э (или зная, что лимонная кислота трехосновная).
b. Используя данные таблицы, рассчитайте концентрацию каждого компонента смеси в стакане с водой до начала реакции;
c. В каком мольном соотношении должны быть реагирующие компоненты, чтобы вкус напитка был кисловатым?
d. Почему при избытке соды раствор становится горьковатым на вкус?
7. В водно-спиртовом растворе хлорида цинка было обнаружено 1,806·1022 хлорид-ионов и 11,56 г соли, не распавшейся на ионы. Определите степень диссоциации соли (в %) в этом растворе.
8. Неизвестный алкен массой 7 г присоединяет бромоводород, объём которого одинаков с объёмом метана массой 2 г (н.у.) Найдите молекулярную формулу алкена и напишите структурные формулы его изомеров.
9. При пропускании 15,68 л смеси метана, углекислого газа и угарного газа через раствор гидроксида калия, взятого в избытке, объем исходной смеси уменьшился на 8,96 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л (н.у.) кислорода.
Определите объемные доли компонентов в исходной смеси.
10. Соль А является соединением металла Х, окрашивающим бесцветное пламя газовой горелки в жёлтый цвет. При нагревании до 300°С А разлагается с образованием хорошо растворимой в воде соли Б. Взаимодействие раствора гидроксида кальция с раствором соли Б или с раствором соли А приводит к выпадению осадка вещества В, которое разлагается при нагревании до 1000°С на газ Г (без запаха) и твёрдое вещество Д. Пропускание газа Г через раствор соли Б приводит к образованию А.
Определите вещества А–Д, напишите уравнения реакций.



